Para los interesados en revisar todo el material adicional acudir a la página http://seram2010.com/modules.php?name=posters
Diagnóstico de
la Parálisis Supranuclear Progresiva con resonancia magnética de 3 T.
Autores: Pilar
Núñez Valentín; Juan Luis Cervera Rodilla; Concepción Ferreiro Argüelles; Eva
López Valdés; Juan Álvarez-Linera*; Juan Antonio Hernández-Tamames*.Hospital Universitario Severo Ochoa. Leganés. Madrid.* UIPA (Fundación CIEN. Reina Sofía). Madrid.
Objetivo:
Demostrar las alteraciones morfológicas observadas en la PSP con la técnica de resonancia magnética (RM) de 3 T convencional y los hallazgos con las técnicas de RM avanzada (tensor de difusión).
Material y Métodos:
Estudio multicéntrico, 16 pacientes remitidos por Unidades de Trastornos del Movimiento, con el diagnóstico de PSP, y 16 pacientes controles pareados por edad y sexo.
Equipo de RM 3T GE, con secuencias convencionales axial 3D IR y reconstrucciones MPR, axial FLAIR, axial EPI GE T2 y tensor de difusión (grosor de corte de 2,4mm, 15 direcciones de gradiente, con un valor b=1000 y matriz 128x128 y FOV 240mm).
Se realiza una lectura doble ciego por dos neurorradiólogos de los datos morfológicos.
Resultados: Los hallazgos neuropatológicos incluyen atrofia del techo del mesencéfalo y del pedúnculo cerebeloso superior, atrofia del núcleo subtalámico y pérdida de la pigmentación de la sustancia negra.
Microscópicamente: Pérdida de neuronas y celulas gliales, con depósitos de ovillos neurofibrilares tau- positivos y fibras neurópilas en el núcleo del Globo pálido (GP), sustancia negra (SN) y núcleo subtalámico (STN). El cortex cerebral está relativamente preservado a excepción de la corteza perirrolándica.
Hallazgos morfológicos más específicos de la PSP:
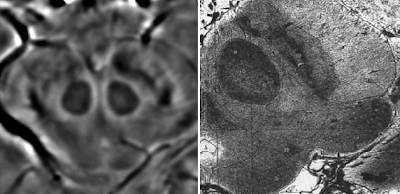
a) Atrofia del mesencéfalo
- Porción rostral aplanada o cóncava.
Imagen a la derecha de un individuo sano es convexo hacia arriba
- Concavidad de los pedúnculos cerebrales.
- Diámetro anteroposterior del mesencéfalo < 17mm.
- Atrofia de la región colicular (lámina tectal).
- Hipointensidad de la pars compacta de la sustancia negra.
Para repasar detalles del mesencéfalo en una RM de 7T
b) Atrofia de los pedunculos cerebelosos superiores, medidos en el punto medio de su trayecto, estableciendo el límite de grosor normal en 3mm.
- La Hipointensidad en FLAIR y T2 con eco gradiente (EG) . de la pars compacta de la sustancia negra. Secuencias AX FLAIR y T2 EG. - PSP: 7 casos. - Control: 0 casos.
En T2 EG se observa más contraste entre tejidos en la señal (el caudado y putamen) Por depositos de minerales
Por depositos de minerales
 Por depositos de minerales
Por depositos de mineralesLa imagen que sigue corresponde a la publicación de Kay L. Double, Gabrielle Todd, Stephen R. Duma. Pathophysiology of Transcranial Sonography Signal Changes in the Human Substantia Nigra. International Review of Neurobiology Volume 90, 2010, Pages 107–120
Imagenes de RM SWI han demostrado su utilidad en estos casos neurodegenerativos con acumulo de hierro, con buena correlación de lo visto con anatomia patológica:
Continuamos con el trabajo de Pilar Núñez Valentín y col:
- En un paciente con PSP no se observaron los rasgos morfológicos característicos.
- La existencia de un tegmento mesencefálico aplanado más presencia de concavidad disminuye la presencia de falsos positivos.
RM por tensor de
difusión: Provee información sobre la arquitectura cerebral basándose en las
propiedades de orientación de las moléculas de agua en el cerebro. Utiliza una
herramienta matemática que consiste en una matriz de 3x3 para describir la
distribución del movimiento del agua en cada vóxel de forma tridimensional.
Las fibras de la
sustancia blanca del cerebro tienen una orientación preferencial por lo que las
moléculas de agua difunden más fácilmente en paralelo a dichas fibras que
perpendicular a las mismas. Esto se conoce como difusión anisotrópica. En la
difusión isotrópica el movimiento es igual en todas las direcciones del espacio
(más típico del LCR y, en menor medida de la sustancia gris cerebral.
La secuencia tradicional
de difusión valora la difusión del agua global en cada tejido. Se aplican
gradientes en las tres direcciones del espacio. La dirección de la fibra es
indicada por el vector principal del tensor.
►
Los parámetros que obtuvieron fueron:
- Imagen
isotrópica. Equivalente a la DWI tradicional. Media geométrica de la
imágenes en T2 potenciadas en difusión derivada de los tres gradientes
ortogonales (x,y,z). El coeficiente de
difusión aparente (ADC) es un post-proceso de las imágenes de difusión que
evalúa cuantitativamente la difusión de las moléculas del agua. El valor normal
es de 700 mm2/Seg.
- Difusividad media. (figs. 8 y 9).
Media de los vectores que cuantifican la difusión en los tres ejes del espacio
(difusión en un vóxel.). El aumento de la difusividad media indica
desestructuración del tejido y aumento de la difusión de las moléculas del
agua.
- Anisotropía. Analiza las
diferencias de difusión entre los tres ejes del espacio. Si es alta el tejido
es muy anisotrópico (sustancia blanca normal, por ejemplo). Si es baja el
tejido es isotrópico (LCR). La fracción de anisotropía (FA) es el parámetro más
usado por ser el más sensible a los valores bajos de anisotropía. Es una escala
que mide la anisotropía en un vóxel dado. Sus valores oscilan entre 0 (máxima
isotropía = agua) y 1 (máxima anisotropía). La disminución de la fracción de
anisotropía indica desestructuración de las fibras de la sustancia blanca y el
aumento de la difusión del agua en todos los planos espaciales.
La tractografía es la representación en 3D del tensor de difusión, a través de un software y dirigido por dos rois trazados por el usuario.
Conclusiones:
En el estudio morfológico
con la RM convencional existen hallazgos representativos y específicos de la
PSP, especialmente la atrofia del mesencéfalo (disminución del diámetro
anteroposterior, concavidad lateral, aplanamiento o concavidad superior “signo
del pingüino”, atrofia colicular (tectal), y atrofia en los pedúnculos
cerebelosos superiores.
El estudio con el tensor
de difusión, demuestra reducción de la fracción de anisotropía y aumento de
la difusividad media en las mismas zonas
y en otras asociadas (cuerpo calloso, región medial de ambos tálamos, etc).
Las aplicaciones del
tensor de difusión (FA y DM), pueden ser útiles en el diagnóstico de los casos
de PSP en donde el estudio morfológico no es concluyente, así como para el
diagnóstico más precoz de la enfermedad.
De otro trabajo les complemento con esto:
La Tractografía en la PSP
ha sido propuesta en el diagnóstico diferencial especialmente cuando se
presenta el síndrome de Richardson (SR) –los resultados apenas se evidencian en
la PSP-Parkinsonismo (PSP-P).
Diferencias clínicas en los cinco subtipos de la PSP. Extraído de:
Williams y Lees, 2010; Rohrer, Paviour y Bronstein, 2010; Williams y Lees,
2009; O’Sullivan, Massey, Williams, Silveira-Moriyama, Kempster, y cols., 2008;
Lubarsky y Juncos, 2008; Williams y cols., 2005.
SR
Síndrome de
Richardson
|
Marcha a sacudidas
(festinación y retropulsión)
Inestabilidad
Postural
Caídes frecuentes
hacia atrás
Cambios de
personalidad
Deterioro cognitivo
moderado-grave
Enlentecimiento de
las sacadas verticales oculares
Parpadeo espontaneo
anormal (congelación y blefaroespasmo)
Discurso lento,
atáxico, con expresión ronca e hipofónica
Disfagia
Síndrome frontal
Ausencia de reflejo
acústico (sobresalto y parpadeo)
Facies anímica
No existe beneficio
de levodopa
|
PSP-P
|
Bradicinesia de
miembros con mayor rigidez que en SR
Temblor postural
espasmódico
Temblor en reposo
Asimetría
Rigidez axial
Mejora leve de los
síntomas motores con levodopa
Parpadeo de reflejo
acústico preservado
Reflejo de sobresalto
ausente
Los síntomas
cognitivos y las caídas aparecen más tardíamente
|
Complejo PSP-SCB
|
Distonía asimétrica
de miembros
Apraxia
Fenómeno del miembro alíen
Enlentecimiento en el
inicio de movimientos oculares sacádicos, con prominencia en el lado que
aparece la apraxia (síntoma diferencial)
|
Afasia progresiva
no fluente
|
Lenguaje espontáneo y
proposicional no fluido, con relativa preservación literaria y pocos errores
en el discurso
Agramatismo
Errores fonémicos con
disartria en la producción de lenguaje
Apraxia del habla
|
Acinesia pura con congelación |
Inicio progresivo de alteraciones de la marcha con titubeo y una consecuente congelación motora, que incluye la escritura, la marcha y el habla.
No hay rigidez,
temblor o demencia en los 5 primeros años
No hay buena
respuesta al tratamiento con levodopa
Reflejo de sobresalto
preservado
Reflejo de parpadeo
acústico preservado
|
Erbetta, Mandelli, Savoiardo, Grisoli, Bizzi y cols. (2009) Realizaron un estudio de imagen con tensor de difusión con 9 pacientes con PSP y 11 pacientes con DCB en el que se mostraban diferencias en los promedios de difusión: los pacientes con PSP mostraban un incremento en los núcleos mediales y anteriores del tálamo (también encontrado en: Messina, Cerasa, Condino, Arabia, Novellino y cols., 2011; Padovani, Borroni, Brambati, Agosti, Broli, y cols., 2006), el cíngulo, el área motora y la corteza motora suplementaria. Aunque los resultados no son concluyentes por el bajo número de sujetos, esto podría suponer una base para explicar las deficiencias práxicas que se presentan en algunos pacientes que desarrollan PSP con demencia.
Un dato interesante que puede llegar a ser un marcador predictivo para el diagnóstico diferencial de la PSP-P y el SR es el nivel de recaptación de la yodobenzamida (Lin, Lin, Weng, Yen, Shen y cols., 2011) con un decremento estriatal en la recaptación en los pacientes con SR, y un incremento en los de PSP.
Sonografía transcraneal
Los estudios de Bouwmans y cols., 2010; Walter, Dressler, Wolters, Probst, Grossmann y cols., 2004 muestran que existe un ensanchamiento del tercer ventrículo significativo en la PSP, en comparación con EP idiopática y con la atrofia multisistémica. Cuando el ensanchamiento del tercer ventrículo es igual o superior a 1 cm y los sujetos presentan sintomatología propia de una taupatía, la posibilidad de que se trate de una PSP arroja valores de sensibilidad del 83%, y un valor predictivo del 100%.











El trabajo que citas al final es: Tomás Romero, F.J. (2011) "Revisión y propuestas para el criterio diagnóstico de la PSP", publicado en la web "www.neuronup.com". Puedo mandarte por e-mail el original corregido en el que se han añadido estudios que complementan el diagnóstico añadiendo variables neuropsicológicas que implican a la cognición social si quieres. Muy interesante el estudio propuesto, y unas imágenes impresionantes. Lo cierto es que quizá todos los implicados en el diagnóstico de la PSP deberíamos cambiar la concepción de la entidad y centrarnos en los factores de dispersión de la proteína tau; es mi opinión pero creo que así se clasificaría correctamente. Lo digo por el número de casos que implican deterioro cognitivo que no es rápido. Como neuropsicólogo creo que ver longitudinalmente la evolución del perfil (de manera paralela a la dispersión de la proteína) ayuda a comprenderlo.
ResponderEliminarUn saludo y os animo a que sigáis exponiendo la realidad de esta enfermedad que tiene un impacto tan grande en la funcionalidad de los pacientes.
Francisco Javier